- · 《临床心电学杂志》期刊[01/26]
- · 《临床心电学杂志》投稿[01/26]
- · 临床心电学杂志版面费是[01/26]
国家药监局年报:批准创新药临床品种1096个
作者:网站采编关键词:
摘要:4月20日,国家药品监督管理局发布《药品监督管理统计年度报告(2020年)》,回顾了一年总成绩。报告分别对药品、医疗器械、化妆品的相关行政受理、审批、监管等情况进行了汇总分
4月20日,国家药品监督管理局发布《药品监督管理统计年度报告(2020年)》,回顾了一年"总成绩"。报告分别对药品、医疗器械、化妆品的相关行政受理、审批、监管等情况进行了汇总分析。其中,关于药品方面:
1. 有效期内药品企业7690家,原料药和制剂企业有4460家
截至 2020 年底,全国有效期内药品生产企业许可证 7690 个 (含中药饮片、医用气体等)。从所生产产品类别看,生产原料药和制剂的企业有 4460 家,生产化学药的企业有 3519 家,生产中成药的企业有 2160 家,生产中药(含饮片)企业 4357 家,生产医用气体的企业有 671 家,生产特殊药品的企业有 224 家。

2. 国产药品批准文号数量件,进口药品注册证4269件
截至 2020 年底,全国共有国产药品批准文号数量 件,进口药品注册证 4269 件。

3. 国产药品上市申请1076件,进口药品上市申请300件
2020 年国家局受理进口(含港澳台)药品临床试验申请 587 件,上市申请 300 件,再注册申请 320 件,补充申请 3685 件;受理国产药品临床试验申请 1099 件,上市申请 1076 件,补充申请 1520 件; 受理仿制药质量和疗效一致性评价申请 881 件,临时进口申请 489 件。

4. 批准879件新药临床,中药天然药9件,生物制品223件
2020年国家局共批准新药临床 879 件(不包含进口药品),其中中药天然药物 9 件,化学药品 647 件,生物制品 223 件;批准按新药申请程序申报临床申请共 181 件,其中中药天然药物 11 件,化学药品 97 件,生物制品 73 件。

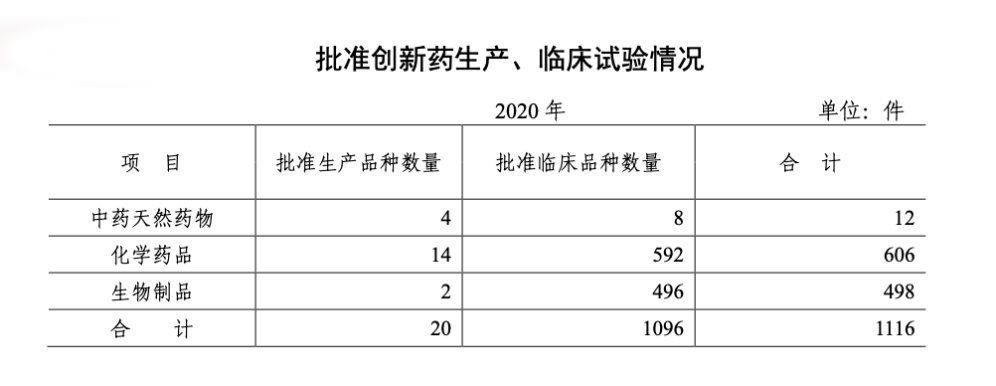
5. 批准创新药临床品种1096个,生产品种20个
2020 年共批准创新药临床品种 1096 个,批准创新药生产品种 20 个。
6. 批准进口药品临床604件,上市128件
2020 年共批准进口药品临床 604 件,上市 128 件。

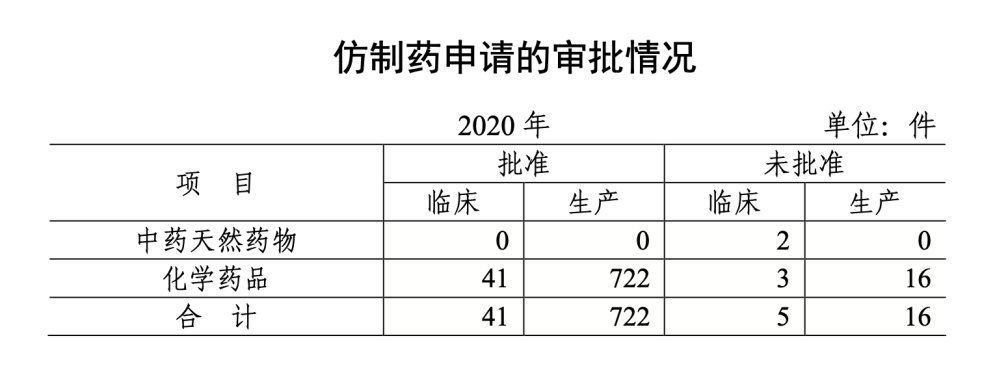
7. 批准仿制药临床41件
2020 年共批准仿制药临床 41 件,生产 722 件。
8. 药品不良反应报告167.58万份,死亡病例报告1489件
2020 年国家药品不良反应监测中心共收到药品不良反应报告 167.58 万份。其中严重病例 16.74 万件,死亡病例报告 1489 件。不良反应报告处理数量 10 件。
2020 年全国共对 55 种药品进行了安全性评价。包括:化学药品 29 种,中药 24 种,生物制品 2 种。按评价结果采取的管理措施分,发布药品不良反应信息通报 1 次,修改说明书 47 个,撤销 3 个。
9. 32 种药品进行了OTC 转换
2020 年国家局对 32 种药品进行了 OTC 转换,其中,化学药处方药转非处方药 6 件;中药处方药转非处方药 26 件。任璇 整理
附《药品监督管理统计年度报告(2020年)》:
文章来源:《临床心电学杂志》 网址: http://www.lcxdxzz.cn/zonghexinwen/2021/0421/819.html