- · 《临床心电学杂志》期刊[01/26]
- · 《临床心电学杂志》投稿[01/26]
- · 临床心电学杂志版面费是[01/26]
当家品种海外临床遭暂停 康弘药业股价应声跌停
作者:网站采编关键词:
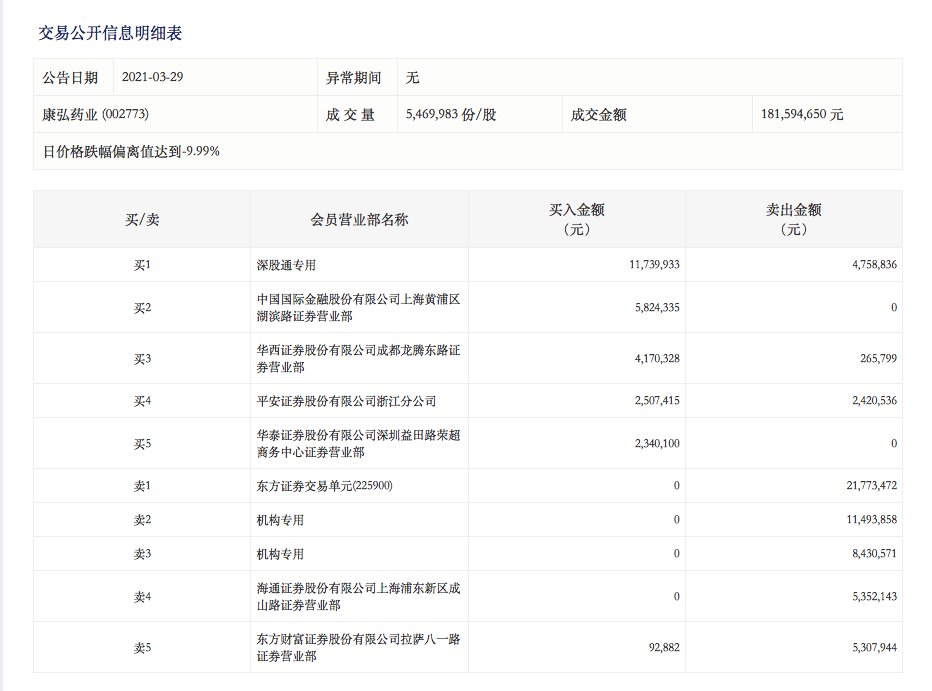
摘要:《科创板日报》(上海,记者 徐红)讯, 受当家产品海外临床试验被暂停消息的影响,29日,康弘药业()股价应声跌停。 29日盘后龙虎榜数据显示,康弘药业当日成交量547万股,成交
《科创板日报》(上海,记者 徐红)讯,受当家产品海外临床试验被暂停消息的影响,29日,康弘药业()股价应声跌停。
29日盘后龙虎榜数据显示,康弘药业当日成交量547万股,成交金额1.8亿元。买入金额前5名买入总计2658.21万元,占当天总成交金额14.65%,卖出金额前五名卖出总计5235.80万元,占当天总成交金额的28.83%。其中,知名游资敢死队—华泰证券股份有限公司深圳益田路荣超商务中心证券营业部现身买五席位,买入金额234万元。
28日晚间,康弘药业披露关于KHB-1802临床试验(法国)的进展公告。据公告,康弘药业全资子公司成都康弘生物科技有限公司(下称“康弘生物”)近日接法国国家药品与健康产品安全局(ANSM)通知,要求公司暂停康柏西普眼用注射液治疗新生血管性年龄相关性黄斑变性患者的法国临床实验(KHB-1802)。
在公告中,康弘药业并未透露试验遭到暂停的原因。公司同时表示仍在主动积极与ANSM保持良好的沟通,并根据实际情况按相关规定和要求开展后续工作。
“新药研发及上市是项长期工作,存在诸多不确定因素,易受到突发公共卫生事件、国际形势的变化、境外审批政策导向等多方面因素的影响,该产品(康柏西普)在法国的临床试验、审评和审批的结果以及时间都具有一定的不确定性。”康弘药业又指出。
29日,就康柏西普法国临床实验遭暂停的具体原因,《科创板日报》记者特联系了公司。对此,康弘药业相关人士回复表示,“目前没有更多的信息可以分享,一切以公告内容为准”。
康柏西普,商品名朗沐,由康弘药业子公司康弘生物研发,是新一代抗VEGF融合蛋白。自2013年获批上市以来,已经先后斩获3个适应症,包括湿性年龄相关性黄斑变性(wAMD)、糖尿病黄斑水肿(DME)和病理性近视脉络膜新生血管(pmCNV)。
此外,在今年1月,康柏西普第四个适应症—视网膜静脉阻塞(RVO)也递交了上市申请。
据公司财报,康柏西普自上市后销售额逐年攀升,2015年至2019年其收入占比攀升至35.5%,净利润占比攀升至50.7%。另据米内网数据,近年来康柏西普眼用注射液在我国公立医疗机构终端眼科用药市场中的份额不断增加,从2015年的3.77%到2019年突破10%,2020年上半年再创新高,跃升到第二位,仅次于诺华的雷珠单抗注射液。
在国内市场高速增长的同时,康弘药业亦积极进军海外市场,希望以此打开康柏西普远期成长空间,公司于2018年5月启动了康柏西普wAMD适应症的与阿柏西普头对头比较的国际多中心三期临床。而根据公司28日晚的公告推测,此次暂停的法国KHB-1802临床试验预计正是该国际多中心三期临床的一部分。
整个国际多中心临床研究将包括两个独立、相似的试验,每个试验计划入组约1140名受试者,以1:1:1的比例分组接受0.5mg康柏西普、1.0mg康柏西普和2.0mg阿柏西普的玻璃体腔注射。研究的主要目标是明确0.5 mg或1.0 mg康柏西普是否非劣效于 2.0 mg阿柏西普,评估方式为采用ETDRS方法来评估第36周最佳矫正视力(BCVA)较基线的变化。主要终点是受试眼第36周ETDRS BCVA 字符数得分较基线的平均变化。
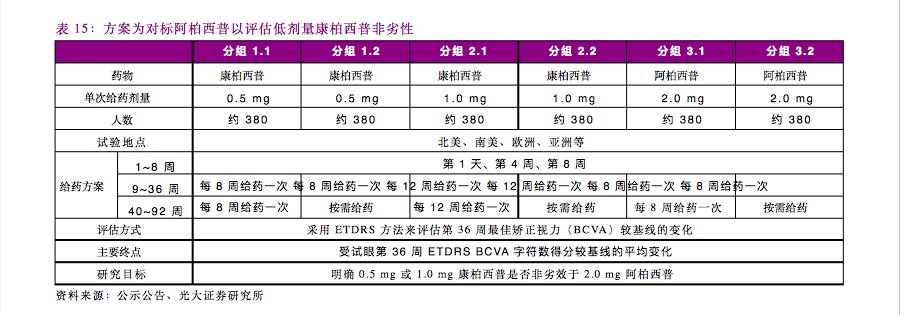
不过,根据本月的一份光大证券研报所称,康柏西普的国际多中心III期临床试验已于2020年9月完成所有受试者的36周核心治疗期,目前正在进行安全性观察、数据整理、数据分析等工作,有望在近期披露临床数据并提交上市。
对此,康弘药业方面向《科创板日报》记者确认,目前完成的是36周的核心治疗期,对应的是核心治疗期数据揭盲,待36周数据揭盲后公司或会寻求以核心治疗期数据申报美国上市。
然而,不管康柏西普最终是否能在海外顺利推进上市,随着海外多款抗VEGF眼科用药的陆续上市及市场竞争的加剧,留给康弘药业的时间可能也并不那么充裕了。
公开信息显示,诺华Beovu(brolucizumab,RTH258)已于2019年10月获美国FDA批准上市,用于治疗湿性年龄相关性黄斑变性(wet-AMD),给药时间间隔与康柏西普一样是3个月。另外,罗氏计划于2021年提交Faricimab(RO,RG7716)用于糖尿病性黄斑水肿(DME)和与年龄相关的湿性黄斑变性(wAMD)的上市申请,而这款药物最终获批的给药时间间隔可能达到4个月。
值得一提的是,为推进康柏西普海外上市,康弘药业还启动了自2015年上市以来首次定增再融资。2020年12月,康弘药业曾发布公告,拟向不超过35名特定对象非公开发行不超1.84亿股,募集资金总额不超过34.72亿元。
文章来源:《临床心电学杂志》 网址: http://www.lcxdxzz.cn/zonghexinwen/2021/0330/676.html
上一篇:检索培训进科室 院图书馆助力临床科研
下一篇:西部首个脑卒中临床培训基地启用