- · 《临床心电学杂志》期刊[01/26]
- · 《临床心电学杂志》投稿[01/26]
- · 临床心电学杂志版面费是[01/26]
复星医药新药临床试验获批 2026年一线肝癌靶向药
作者:网站采编关键词:
摘要:每经记者 赵李南每经编辑 梁枭 今日(3月17日)晚间,复星医药(,SH)发布公告称,其控股子公司重庆药友制药有限责任公司(以下简称重庆药友)收到国家药品监督管理局(以下简
每经记者 赵李南每经编辑 梁枭
今日(3月17日)晚间,复星医药(,SH)发布公告称,其控股子公司重庆药友制药有限责任公司(以下简称重庆药友)收到国家药品监督管理局(以下简称国家药监局)关于同意YP01001胶囊用于晚期实体瘤治疗开展临床试验的批准。
《每日经济新闻》记者注意到,我国已上市的复星医药YP01001胶囊同类型药品有甲磺酸仑伐替尼胶囊等。拟在科创板上市的北京盛诺基医药科技股份有限公司(以下简称盛诺基)招股书中写到,据研究机构Frost&Sullivan;预测,2026年我国肝细胞癌一线靶向药市场整体规模将达到111.73亿元。
复星医药布局晚期肝癌小分子靶向药据复星医药此前公告,今年1月,重庆药友收到国家药监局下发的《受理通知书》,其递交的临床试验注册审评获受理。复星医药表示,YP01001胶囊主要用于治疗晚期实体瘤(肝癌、胃癌等)。重庆药友拟于近期条件具备后于中国境内开展YP01001胶囊的I期临床试验。
“该新药为创新型小分子化学药物,拟用于治疗晚期实体瘤;该新药临床前开发由本集团与上海药明康德新药开发有限公司合作开展、临床及以后阶段的开发拟由本集团自主实施。”复星医药表示。据复星医药透露,截至2021年2月,集团现阶段针对YP01001胶囊累计研发投入约为3366万元(未经审计)。
值得注意的是,抗肿瘤领域在复星医药的业务板块中属于“后起之秀”。2020年上半年,复星医药在抗肿瘤治疗领域取得强劲增长。据复星医药2020年半年报,“抗肿瘤治疗领域核心产品”实现营业收入约4.2亿元,同比增长59.94%。
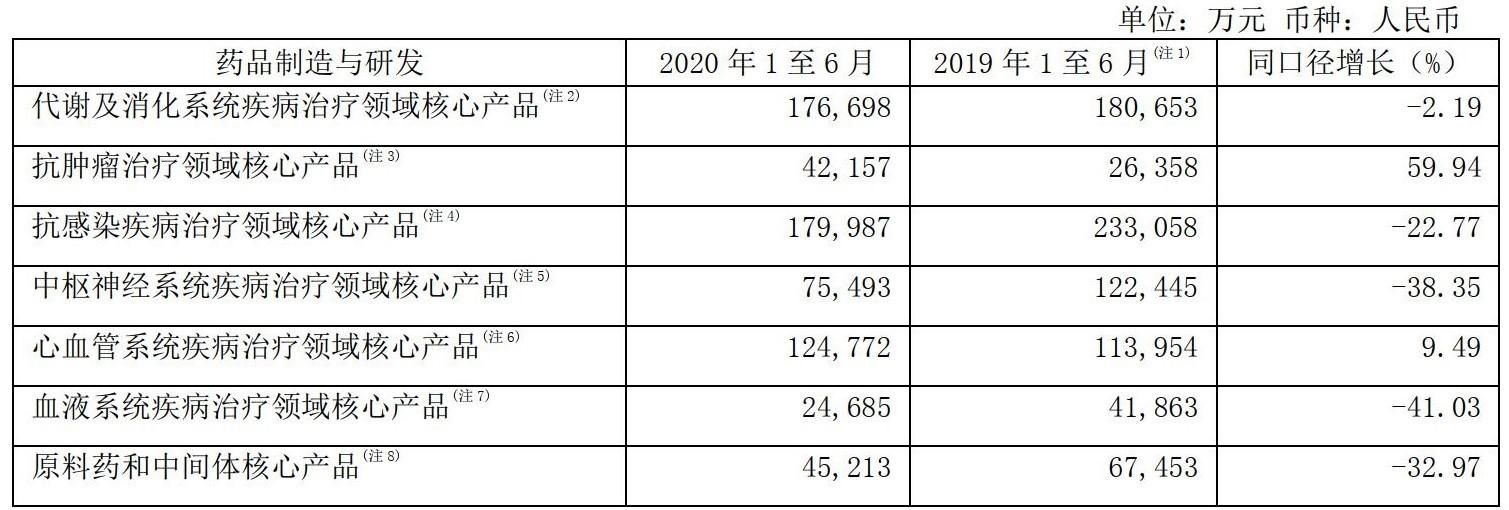
图片来源:复星医药2020年半年报截图
据复星医药转引IQVIA CHPA数据(由IQVIA提供,IQVIA是全球领先的医药健康产业专业信息和战略咨询服务提供商),2020年度,甲磺酸仑伐替尼胶囊在中国境内的销售额约为8928万元。
此外,据复星医药此前披露,公司对于晚期恶性实体瘤的小分子靶向药的布局还包括新药“注射用FN-1501”,该药品的临床试验也已经获批。
研究机构:未来五年市场规模超百亿据成都倍特药业股份有限公司(以下简称倍特药业)招股书,甲磺酸仑伐替尼胶囊原研厂商为Eisai Europe Ltd.(日本制药厂商,以下简称卫材公司),该药于2018年9月在国内获批上市,国内正大天晴等3个厂家申报。
倍特药业在招股书中表示:“仑伐替尼的III期临床硏究表明,相比现有疗效证据最充分的一线治疗药物索拉非尼,仑伐替尼尽管在总生存期上没有显著差异,但可显著提高客观缓解率(40.6%VS12.4%)和无进展生存期(7.3VS3.6个月),而针对中国患者,仑伐替尼可提高总生存期(月),降低50%的死亡风险。”
《每日经济新闻》记者注意到,由于仑伐替尼竞争优势,其近年来在国内的销售额迅速增长。盛诺基在招股书中转引卫材公司数据,2018年、2019年和2020年1~9月,仑伐替尼在我国的销售额分别为1.11亿元、7.93亿元和7.29亿元。
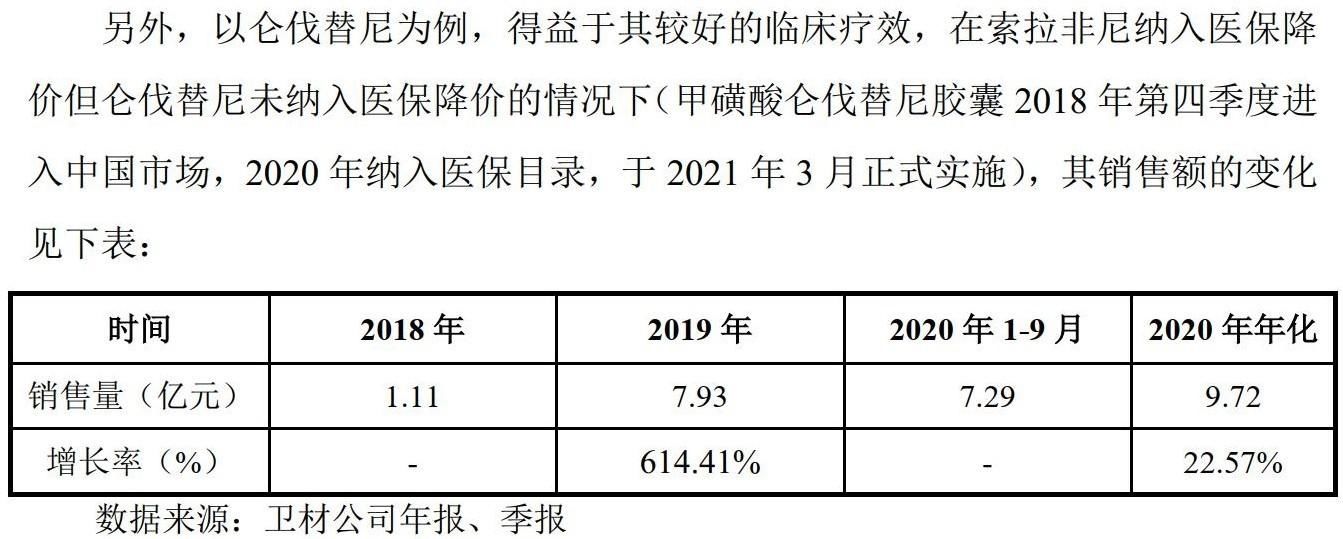
图片来源:盛诺基招股书截图
根据2020年《中国临床肿瘤学会(CSCO)原发性肝癌诊疗指南》,目前晚期肝细胞癌一线治疗推荐药物(1A类证据)包括索拉非尼、仑伐替尼、多纳非尼、阿替利珠单抗联合贝伐珠单抗和FOLFOX4化疗方案。
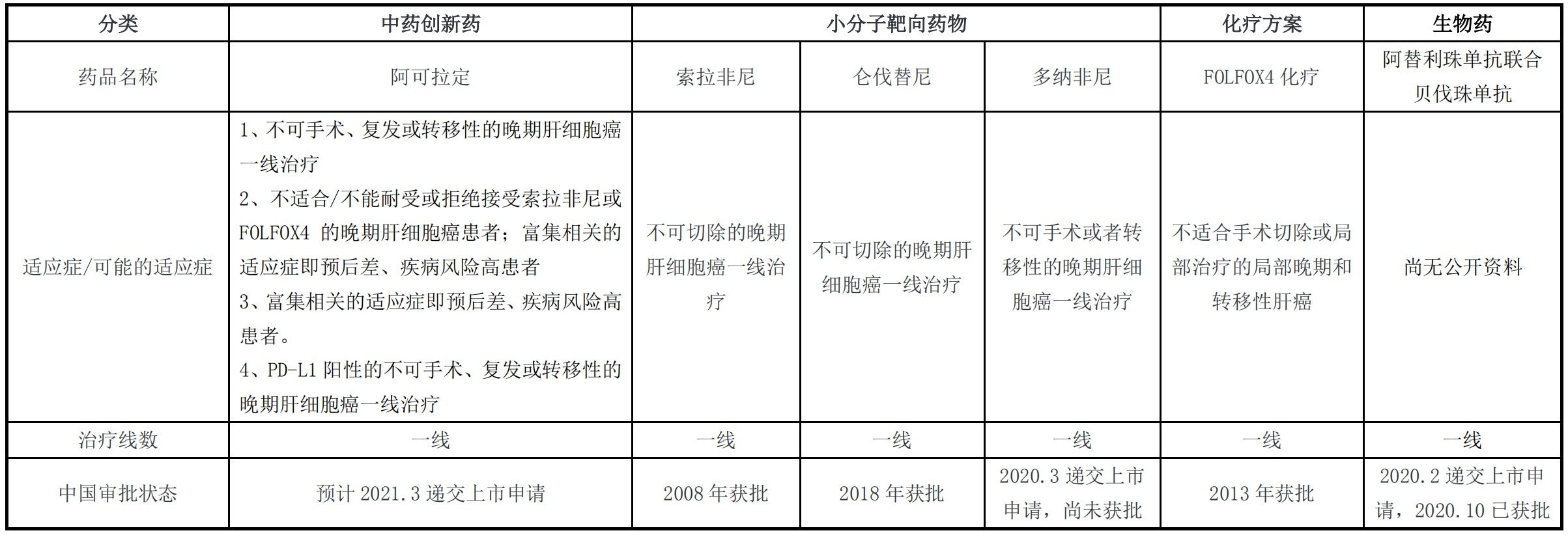
图片来源:盛诺基第二轮审核问询函之回复报告截图
据盛诺基招股书,2020年5月15日,多纳非尼的上市申请获得国家药监局受理,尚未获得批准。多家企业已经提交关于索拉非尼仿制药的上市申请,目前江西山香药业有限公司的首仿药已于2020年8月7日获得国家药监局批准上市。2020年10月28日,PD-L1免疫抑制剂阿替利珠单抗联合贝伐珠单抗用于既往未接受过系统治疗的不可切除肝细胞癌患者的方案已在我国获批。
“根据Frost&Sullivan;数据,索拉非尼2019年中国区销售额可达12.8亿元,较2018年增长80.3%。根据仑伐替尼开发厂家日本卫材公司财报显示,仑伐替尼2019年中国市场销售额约合7.93亿元,较2018年1.11亿元增长614.4%。根据Frost&Sullivan;预测,2026年国内肝细胞癌一线靶向药市场整体规模将达到111.73亿元。”盛诺基在招股书中写到。
盛诺基还认为:“随着患者对肝癌药物认知的普及以及市场教育度的提升,晚期肝细胞癌市场一线治疗药物的渗透率会不断提高,整体规模也将持续快速增长。”
文章来源:《临床心电学杂志》 网址: http://www.lcxdxzz.cn/zonghexinwen/2021/0318/585.html
临床心电学杂志投稿 | 临床心电学杂志编辑部| 临床心电学杂志版面费 | 临床心电学杂志论文发表 | 临床心电学杂志最新目录
Copyright © 2019 《临床心电学杂志》杂志社 版权所有
投稿电话: 投稿邮箱: